Site Web dédié : https://bms.lpl.univ-paris13.fr
1 – Vers une caractérisation des origines moléculaires des effects indirects d’irradiation
C. Desfrançois, F. Lecomte, N. Nieuwjaer et B. Manil
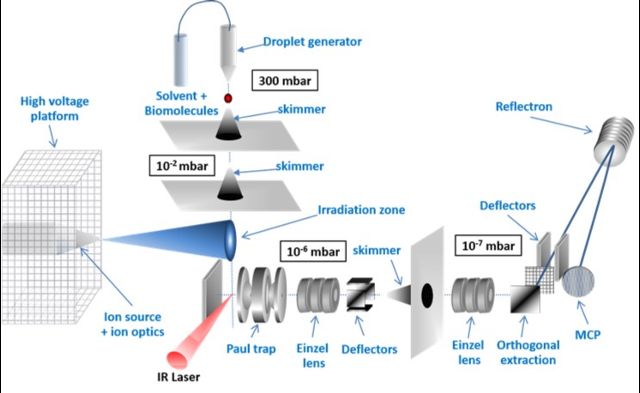
La dernière réalisation expérimentale de l’équipe BMS a été le développement d’une technique alternative pour obtenir des biomolécules et leurs complexes directement sous vide dans des conditions aussi proches que celles rencontrées en solution. Ce nouveau type source n’existe pas en France et repose sur une désorption laser ultra-douce de microgouttelettes liquides sous vide. Les complexes désorbés initialement présents dans le liquide peuvent ainsi être identifiés et caractérisés en phase gazeuse dans des conditions soigneusement choisies et dans un environnement contrôlé proche de leurs formes natives en solution. Cette source est basée sur un concept développé à l’origine par B. Brutschy (Université de Francfort): de grandes biomolécules sont mises en phase gazeuse par désorption laser non résonnante sur des microgouttelettes. Nous développons une telle source et nous avons obtenu des résultats prometteurs. Dans notre dispositif, les microgouttelettes liquides (50 micromètres de diamètre) sont générées à la demande par un générateur de gouttelettes commercial (Microdrop) et injectées de 300 mbar dans une chambre où règne un vide secondaire (10-6 mbar) via le passage par des étages de pompage différentiel. Lors de l’irradiation par des impulsions laser à large bande dans l’IR moyen (centré sur une bande d’absorption du solvant), les ions (et les espèces neutres) sont éjectés directement sous vide. La désorption se produit à l’entrée d’un piège de Paul dans lequel les ions sont guidés par un champ électrostatique faible, afin d’éviter toute fragmentation ou activation lors des collisions avec le gaz tampon du piège. Les ions sont ensuite éjectés du piège, accélérés, focalisés et détectés par des galettes à microcanaux dans une seconde chambre (10-7 mbar). Les résultats préliminaires montrent des complexes non covalents conservés, ce qui prouve que le processus de désorption est suffisamment doux pour préserver les interactions moléculaires faibles. Cette source représente alors une percée importante dans le domaine des techniques d’analyse en phase gazeuse appliquées aux systèmes biologiques pertinents et nous donnera l’occasion unique d’obtenir des informations sur les processus d’endommagement au niveau moléculaire, en utilisant des techniques d’analyse en phase gazeuse. En effet, via le couplage de ce montage expérimental avec une plate-forme d’irradiation aux ions (voir la figure), on bombardera les microgouttelettes (solvant + biomolécules) par des ions simplement chargés d’une énergie cinétique de quelques dixièmes de keV.
Cette irradiation va ainsi créer une cascade radiolytique (électrons et radicaux solvatés) dans une couche superficielle (premières centaines de nanomètres) de la gouttelette. Cela correspond au stade physico-chimique de l’irradiation, qui est bien connu à travers l’étude de la radiolyse de l’eau. Au cours de l’étape suivante (chimique), les radicaux libres vont migrer et réagir avec les biomolécules dans la zone non irradiée. Or, cette seconde étape est beaucoup moins bien caractérisée pour la radiolyse de l’eau et presque totalement non comprise dans le cas des biomolécules. En analysant en masse les produits biomoléculaires après irradiation et radiolyse à l’intérieur des microgouttelettes, notre méthode expérimentale nous donnera donc la possibilité d’étudier pour la première fois ces processus de chimie radicalaire, liés aux effets indirects, exempts de toute autre contribution aux radiations.
Contact : Nicolas NIEUWJAER
Références : R. Lozada Garcia, S.D. Leite, F. Lecomte, N. Nieuwjaer, C. Desfrançois et B. Manil (in preparation)
Principal soutien financier : BIORAD (2015-2018, INCa-INSERM)
2 – Caractérisation structurale de biomolécules
C. Desfrançois, F. Lecomte, N. Nieuwjaer and B. Manil
Ces dernières années, l’équipe de BMS s’est impliquée dans des collaborations fructueuses avec d’autres groupes expérimentaux afin d’étendre son activité de recherche à l’étude de biomolécules modèles par une approche combinée de spectroscopie laser et de spectrométrie de masse. Pour ce faire, nous effectuons la spectroscopie IR de systèmes neutres ou ioniques sélectionnés en isomères et en masse (bases d’acides nucléiques, acides aminés, peptides, médicaments) et de leurs complexes non covalents en phase gazeuse. L’assignation structurale est faite par comparaison avec des calculs de chimie quantique de haut niveau. Récemment, nous avons réalisé une expérience avec le groupe de G. Grégoire (ISMO-Orsay) pour étudier les spectres vibroniques des hydroxypyridines protonées (HPH), dont les dérivés sont des photosensibilisateurs endogènes ou synthétiques qui pourraient contribuer aux dommages du rayonnement solaire. L’étude de leurs états excités pourrait conduire à une meilleure compréhension de leurs mécanismes d’action. Nous avons obtenu les spectres ultraviolets (UV) de la 2-, 3- et 4-hydroxypyridine protonée. Ils affichent des structures vibrationnelles bien résolues, avec une nette influence de la position du groupe OH. Ces résultats sont interprétés avec des calculs d’états excités au niveau CC2.
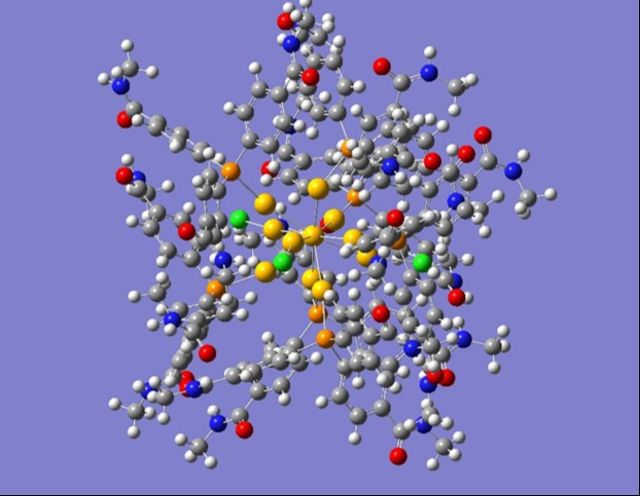
Nous cherchons également à étudier des nano-agrégats ligandés (voir figure), après sélection en masse en phase gazeuse, en utilisant une spectroscopie laser IRMPD sur l’installation CLIO (Laser à électrons libres d’Orsay). L’avantage de la sélection en masse est d’éviter toute contribution du solvant ou des dispersions en tailles d’agrégats pour simplifier la comparaison avec les calculs chimiques quantiques. Les spectres IR (réalisés dans une large gamme de longueurs d’onde IR: 3 à 100 μm) donneront une signature univoque pour les assignations structurelles. L’objectif est de mieux comprendre la nature des interactions métal-ligand liées à des processus physiques et chimiques impliqués dans diverses applications biologiques (greffe, fonctionnalisation, photothérapie, radiosensibilisation …) utilisant des nanoparticules.
Contact : Charles Desfrançois
T.N. Le, J-C. Poully, F. Lecomte, N. Nieuwjaer, B. Manil, C. Desfrançois, F. Chirot, J. Lemoine, P. Dugourd, G. van der Rest, G. Grégoire,
Journal of the American Society for Mass Spectrometry, 24, 1937, (2013).
